Chirurgische Therapie des Hodenhochstandes
Der Begriff Hodenretention beschreibt eine Fehllage der Gonade auf ihrem vorgegebenen Weg, dem physiologischen Descensus in das Scrotalfach. In der Mehrzahl der Fälle ist die Phase des inguinoscrotalen Descensus in der späten Schwangerschaft gestört, so dass sich die retinierten Hoden knapp vor dem äußeren Leistenring (60%) bzw. im distalen Leistenkanal finden. Auch wenn eine Hormontherapie (z.B. nasales GnRH; Kryptochur®; 1. Behandlungszyklus vor dem 1. Lebensjahr) nicht zu einem weiteren Deszensus geführt hat, so ergeben sich, neben einer Verbesserung der späteren Fertilität (Transformation des Stammzellpools), auch für den operativen Eingriff positive Effekte im Sinne einer Vergrößerung und Verfestigung des Hodens und des Samenstranggewebe (9,14). Von der primären Hodenretention ist die sekundäre Ascension der Gonade zu unterscheiden (2). D.h. ein primär im Scrotalfach lokalisierter Hoden retrahiert sich zunehmend aufgrund eines inadäquaten Längenwachstums bzw. wegen retinierender fibröser Anteile des Funiculus spermaticus (4).
Seltener findet man Hodenektopien, wo die Gonade deutlich außerhalb des Weges des physiologischen Deszensus liegt. Die Ursache liegt in einer groben Fehlinsertion des Gubernaculum testis. Hier ist die inguinal – epifasziale Ektopie (ca. 70%) am häufigsten zu sehen. Daneben finden sich Formen der penilen (an der Wurzel des Penis), der femoralen, der transversalen und der perinealen Ektopie.
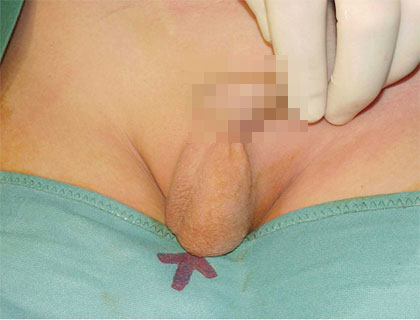
Abb. 1: Eine einseitige Retentio testis
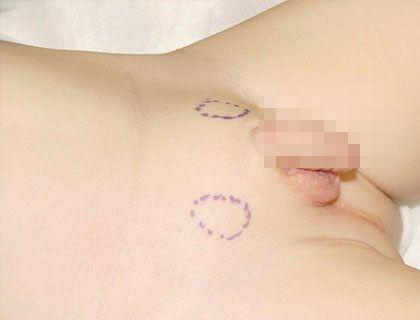
Abb. 2: Eine beidseitige Retentio testis mit hypoplastischem Scrotum
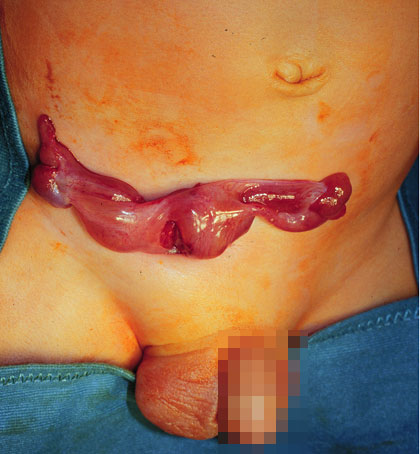
Abb. 3: Bild einer transversen Hodenektopie nach inguinaler Freilegung,
wobei die Gonaden über eine fibröse Brücke miteinander verschmolzen sind.
Diagnostik:
Die Palpation steht deutlich an erster Stelle und wird am besten bei liegendem Kind vorgenommen. Vor allem in den ersten 3 Monaten, wo der Cremasterreflex noch nicht stark ausgebildet ist oder fehlt ergeben sich relevante Befunde, einschränkend dem Umstand, dass zu einem späteren Zeitpunkt die sogenannte sekundäre Aszension der Gonade vorkommen kann. Wir empfehlen bei fraglichen Befunden und schwierigen Untersuchungsbedingungen (z.B. adipöses Kind) mehrere Untersuchungswiederholungen vor der endgültigen Diagnosestellung, da bei „oberflächlichem“ Untersuchungsgang ein Pendelhoden als Retentio testis fehlgedeutet werden kann. Die Untersuchung muss immer bimanuell vorgenommen werden. Dabei wird beim Hodenhochstand rechts mit der linken Hand der Leistenkanal komprimiert, um ein Hochgleiten des Hodens durch taktile Reizung der Haut zu verhindern. Anschließend wird versucht, den Hoden mit der rechten Hand von scrotal oder in der Inguinalregion zu palpieren. Die Untersuchung der linken Seite erfolgt spiegelverkehrt in gleicher Weise. Differentialdiagnostisch weist der retinierte Hoden weist differentialdiagnostisch gegenüber den inguinalen Lymphknoten eine größere Beweglichkeit auf. Die korrekte Lage des Hodens kann beispielsweise durch Messung des Abstandes zwischen dem Tuberculum pubicum und Hodenmittelpunkt objektiviert werden. Dieser Abstand ist bei Kindern vom ersten Lebensmonat bis zum 7. Lebensjahr mit einer Distanz von 6 ± 1 cm relativ konstant ist (16).
Neben der Inspektion und der bimanuellen Palpation spielt heute die Laparoskopie (so genannter umbilicaler 2mm Miniport) eine wesentliche Rolle, während die Sonographie, die Computertomographie und die Magnetresonanz als diagnostische Instrumente der Hodenlokalisation in den Hintergrund getreten sind. Somit ist die diagnostische Methode der Wahl bei einseitig und beidseitig nicht palpablen Hoden die Laparoskopie. Das kritische Detail liegt in der Verfolgung der Vasa testicularis und des Ductus deferens. Beide Strukturen sollten in den inneren Leistenring eintreten. Neben der Morphologie der Samenstranggebilde kann bei abdominellem Hoden die Lage und die Hoden - Nebenhodendissotiation beurteilt werden (23). Eine deutliche Hoden -Nebenhodendissotiation deutet auf ein Fertilitätsdefizit hin. Das gilt auch für retinierte Hoden im Leistenkanal. Die Laparoskopie erleichtert auch die Planung und Durchführung der späteren Orchidolyse und Orchidopexie. Bei Vorliegen einer hohen Retention in Form eines intraabdominalen Hodens kann hier bereits der Klips - Verschluss der Vasa testicularis im Rahmen einer zweizeitigen Fowler-Stephens Korrekturvorgenommen werden (5). Bei adipösen Säuglingen und Kleinkindern ist der Nachweis des Hodens im Leistenkanal durch die Sonographie möglich. Die Aussagekraft der Untersuchung ist allerdings von günstigen Untersuchungsbedingungen (hochauflösender Linearschallkopf von 7,5 MHz und ein ruhiges Kind) abhängig. Der Nachweis eines Bauchhodens ist sonographisch nicht sicher möglich. Sind beide Hoden nicht tastbar, erfolgt zunächst eine hormonelle Abklärung mit einem sogenannten Chorion-Gonadotropin-Stimulationstest: D.h. Verabreichung von 5000 IE/m2 Körperoberfläche HCG i.m. und Bestimmung des Testosteronspiegels als Ausgangswert, sowie 24 und 72 Stunden nach der Injektion. Ein Anstieg des Testosteronspiegels spricht für das Vorliegen von normalem Hodengewebe und unveränderte Werte sprechen für fehlendes Hodengewebe.
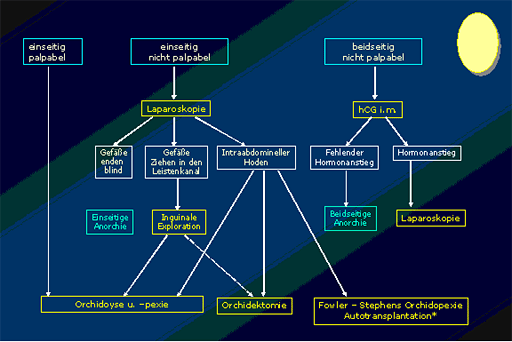
Abb. 4: Algorythmus der diagnostischen und therapeutischen Vorgangsweise.
* Einschränkung durch die Größenverhältnisse um das 1 LJ.
Operationszeitpunkt:
Der empfohlene Operationszeitpunkt hat sich während der letzten Jahre zunehmend in das jüngere Alter verlagert. Von 1950 bis 1960 empfahl man zwischen 9 und 11 Jahren, von 1970 bis 1980 im Vorschulalter, 1990 im Alter vor dem 2. Lebensjahr und heute, der späteren Fertlität wegen, nach einer Empfehlung der American Academy of Pediatrics bereits um das 1. Lebensjahr zu operieren. Gegen Ende des 1. Lebensjahres ist ein weiterer Descensus der Gonade nahezu ausgeschlossen. Eine Fertilitätsbeeinträchtigung der kontralateralen, regulär positionierten, Gonade ist in diesem Alter nicht zu erwarten. Somit ergibt sich die Indikation für eine operative Korrektur im Zeitraum um das 1. Lebensjahr und das aber unter dem Gesichtspunkt, dass die Operation mit Erfahrung, Routine und Verwendung einer optischen Vergrößerungseinrichtung (Lupenbrille, ev. Mikroskop) durchgeführt wird. Wir halten es für einen Fehler diese Operation ohne Lupenbrille durchzuführen. Erfolgreiche Korrekturen sind bereist ab dem 6. Lebensmonat beschrieben, wobei aber folgendes zu bedenken ist. Je jünger der Patient, desto zarter und verletzlicher, auch durch Dehnung, sind die Samenstranggebilde und damit Perfusionsprobleme der Gonade auslösbar. Bei einer Korrektur um das 1. Lebensjahr ist mit einem späteren normalen Fertility – Index zu rechnen (17). Nach dem 2. Lebensjahr steigt die Infertilitätsrate signifikant an und mit zunehmendem Alter beschreiben Autoren einen möglichen Zusammenhang mit dem Grad der Dysplasie und damit mit dem Entartungsrisiko (18, 21, 8). Mit einer Schädigung des kontralateralen Hodens ist erst zu rechnen wenn mit der Korrektur bis in den Bereich des 6. Lebensjahres zugewartet wird. Dieser Zeitraum ist, im Hinblick auf die Fertilitätsbeeinträchtigung, aus heutiger Sicht als absolut obsolet und als inakzeptabel darzustellen.
Das Risiko einer malignen Entartung ist für einen hochstehenden Hoden beträchtlich und wurde im Vergleich zum deszendierten Hoden als 35-50 mal höher beschrieben (23). Allerdings bezog man sich in dieser Untersuchung auf 0,3% kryptorche Männer, dies erscheint im Vergleich zu anderen Beobachtungen unverhältnismäßig niedrig. Heute schätzt man das Risiko realistisch auf das 5-10 fach (10). Am höchsten ist das Risiko für den intraabdominal gelegenen Hoden. Es ist 5x höher als bei einem inguinalen Hoden (15). 10 % aller Keimzelltumore treten im nicht descendierten Hoden auf, wobei wahrscheinlich nicht so sehr die anatomische Fehllage, als vielmehr die Abnormität und die Dysplasie des Hoden ausschlaggebend sind (11). Vergleichbar zu den Tumoren im deszendierten Hoden entstehen die Hodenmalignome bei Maldeszensus ebenfalls im Alter von 20-40 Jahren. Bei einseitigem Maldescensus besteht auch für den normal descendierten kontralateralen Hoden ein erhöhtes Malignomrisiko (7,12). Nach bisherigen Beobachtungen eliminiert eine operative Verlagerung des Hoden das Malignomrisiko nicht (1). Man muss aber in diesem Zusammenhang anführen, dass die Orchidopexien in diesen Untersuchungen, nach heutigem Gesichtspunkt, spät erfolgt sind. Vergleichbare Resultate der "modernen" frühen Orchidopexie um das 1. Lebensjahr liegen noch nicht vor. Ein Vorteil der Orchidopexie ist, dass die Entwicklung eines Hodentumors bei der im Scrotalfach pexierten Gonade früher erkannt werden kann.
Operative Strategien:
Ziel der operativen Therapie ist es um das 1., spätestens bis zum 2. Lebensjahr, bei allen Formen der Hodenretention sowie der Hodenektopie – aus unserer Sicht günstiger Weise ergänzt durch eine Hormontherapie - die retinierte Gonade in das Scrotalfach zu verlagern und damit ihre Umgebungstemperatur (um 33°C) zu senken. Durch den Maldeszensus ist der Hoden einer höheren Temperatur ausgesetzt. Die Temperatur im Skrotum liegt um mehrere Grad Celsius tiefer als die intraabdominelle Temperatur. Dies soll für die fehlende bzw. mangelnde Reifung des Hodengewebes verantwortlich sein. Die Folge ist eine herabgesetzte Fertilität.
Die operativen Strategien bei einer Retentio testis bzw. einer komplexeren Hodenektopie gliedern sich grundsätzlich in folgende Möglichkeiten:
1. Die Orchidolyse mit dem Ziel der scrotalen Orchidopexie n. Shoemaker bzw. nach Fowler – Stephens, ergänzt in speziellen Fällen bei nicht palpablem Hoden durch die Laparoskopie (20, 6).
Bei der typischen Hodenretention mit palpabler Gonade in der Inguinalregion hat sich seit Jahren die Orchidolyse und Orchidopexie bewährt. Es erfolgt eine schräge Inzision in der Unterbauchhautfalte (Langersche Linie) nahe dem äußeren Leistenring mit Durchtrennung der Fascia subcutanea. Die Paparation hat vorsichtig zu erfolgen zumal bereits direkt unter der subkutanen Faszie die retinierte Gonade zu erwarten ist.
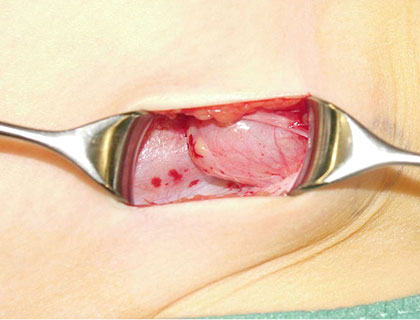
Abb. 5: Eine epifaszial gelegene Gonade
In einem weiteren Schritt wird die Aponeurose des M. obliquus gespalten und damit der Leistenkanal unter Schonung des N. ilioinguinalis eröffnet. Der Hoden wird mobilisiert und der Funiculus spermaticus mit einem Vessel Loop angeschlungen. Distal finden sich die Strukturen des Gubernaculum testis. Durch leichten Zug an diesem Ligament erkennt man in bestimmten Fällen eine Hauteinziehung und die Fehlinsertion des Gubernaculums beispielsweise im Bereich der oberen Scrotalapertur. Das Gubernaculum testis wird üblicherweise mit der bipolaren Pinzette verschorft und durchtrennt. Die retinierte Gonade sollte intraoperativ vermessen werden.
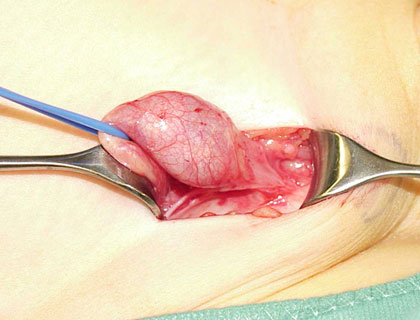
Abb. 6: Die partiell mobilisierte Gonade, wobei sich das Gubernaculum testis anspannt.
Danach erfolgt die präparative Darstellung des Processus vaginalis. Diese Struktur wird durchtrennt und die dorsal anhaftenden Samenstranggebilde mit teils stumpfer, teils scharfer Präparation gelöst.
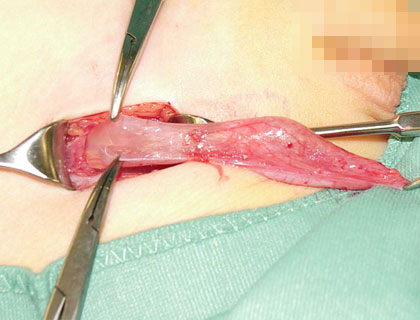
Abb. 7: Präparation des Processus vaginalis peritonei
Der proximale Anteil, der in den inneren Leistenring übergeht wird mit einer Klemme gefasst und hochgeschlagen.
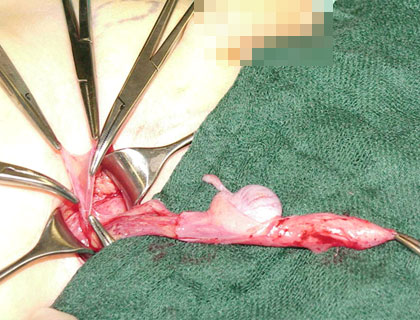
Abb. 8: Der offene Processus vaginalis peritonei ist mobilisiert und hochgeschlagen.
Die Vasa testicularis verläuft im Retroperitoneum in einem nach Lateral ausgerichteten Bogen. Um die Gefäße in einen gestreckten Verlauf zu bringen und damit an Länge zu gewinnen müssen sie bis weit in das Retroperitoneum mobilisert werden. Hier sind bindegewebige Stränge oftmals zu durchtrennen. In einem nächsten Schritt erfolgt die Durchtrennung jeglicher Cremasterfasern.
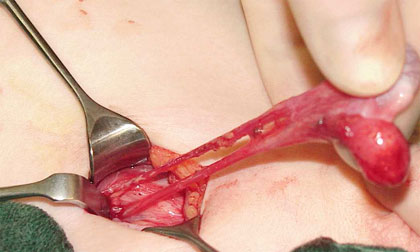
Abb. 9: Nach Durchtrennung der Cremasterfasern und kompletter Lösung fibröser Gewebestränge.
Eine zusätzliche Länge, im Sinne eines gestreckteren Verlaufes erzielt man nach Spaltung der Fascia transversalis in Form der Durchtrennung der Vasa epigastrica inferior (so genanntes Prentiss Manöver). Alternativ kann man die Samenstranggebilde auch unter der Vasa epigastrica durchziehen (Tunnelierung) und so nach medial, eben in gestreckterer Form, verlagern. Diese Maßnahmen sind in der Regel ausreichend.
Falls die Länge des Funiculus spermaticus noch immer nicht ausreicht besteht die Möglichkeit einer einzeitigen Folwer–Stephens Korrektur, wobei die Vasa testicularis, mit Schutz der Gefäßkollateralen, so hoch wie möglich, d.h. weit vom Hoden entfernt, durchtrennt werden soll (6). Die Blutversorgung erfolgt nun nur über die Art. Ducti deferentis. Bei dieser Methode sind allerdings spätere Hodenatrophieraten bis zu 30% zu erwarten. Etwas günstiger sehen wir die Erfolge bei einem zweizeitigen Vorgehen, besonders bei intraabdominalem Hoden, wobei primär im Rahmen der Laparoskopie die Vasa testicularis durchtrennt und der Hoden erst nach einem Intervall von ca. 6 Monaten vom inguinalen Zugang aus lysiert und pexiert wird (5).
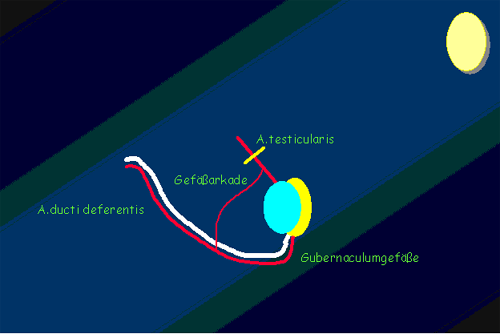
Abb. 10: Gefäßversorgung des Hodens
Nach ausreichender Mobilisierung erfolgt die subcutane Tunnelierung bis in das Scrotalfach. Die Scrotalhaut wird in einer Länge von etwa 1-2 cm inzidiert bis die Tunica dartos (Dartos Faszie) zur Darstellung kommt. Über dieser Faszie wird eine subcutane Tasche (vornämlich in dorsaler Richtung) gebildet in die die mobilisierte Gonade eingelegt wird. Nach Inzision der Tunica dartos erfolgt der Durchzug des Hodens von Inguinal nach scrotal. Wir belassen die Hodenhüllen, im Sinne einer physiologischen Verschiebeschicht. Nach Kontrolle der gerade verlaufenden Samenstranggebilde (Torsion?) erfolgt die Fixation des Hodens an der Tunica dartos mit ein bis zwei monophilen, lang resorbierbaren Nähten (Monoplus®), wobei die Hodenhüllen bzw. die Tunica albuginea oberflächlich gefasst werden. Nähte durch das Hodengewebe sollten vermieden werden (Parenchymschäden „per se“ und ein diskutierter immunologischer Trigger). Eine Pexierungsnaht im Nebenhoden ist strikt zu vermeiden. Die Pexie des Hodens an den Hodenhüllen dient der Fixierung in der neuen Lage und der Torsionsprophylaxe. Zur postoperativen Adhäsionsprophylaxe des lysierten und neu positionierten Funiculus spermaticus aplizieren wir lokal ein Hyaluronsäure - Gel (Hyalobarrier - Gel®). Eine Drainage ist, wenn überhaupt, nur bei Rezidiveingriffen indiziert. Anschließend wird die der Leistenkanal durch Naht der Externusaponeurose geschlossen. Es folgt die Naht der subcutanen Faszie. Die Haut schließen wir mit einer fortlaufenden intracutanen Naht.
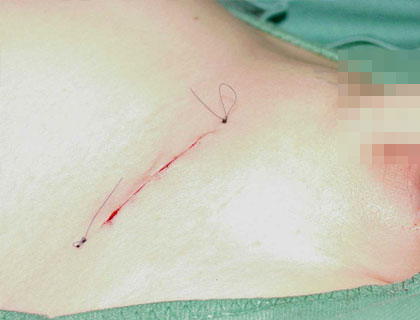
Abb. 11: Die abgeschlossene Korrektur
2. Die Autotransplantation eines sog. Bauchhodens mit mikrovasculärer Anastomose (22, 3). Mit fortschreitender Verbesserung der Mikrogefäßchirurgie wurde die freie Hodentransplantation vorgestellt. Diese Technik wird aufgrund des kleinen Gefäßkalibers frühestens nach dem 2. Lebensjahr durchgeführt und ist technisch auch in dieser Altersgruppe aufwendig und problematisch. Wenn wir heute, im Sinne einer optimalen Fertilität, bereits um das 1. Lebensjahr korrigieren, so sind die Gefäße in dieser Altersgruppe auch mit mikrochirurgischen Techniken, nicht anastomosierbar.
3. Die Orchidektomie (13). In bestimmten Situationen ist die Orchidektomie unumgänglich. Die Indikation dazu wird man umso eher stellen, je älter das Kind ist (Pubertät), je kleiner und dysgenetischer der Hoden, je höher der Hoden retiniert ist, je ausgeprägter eine Hoden - Nebenhodendissoziation vorliegt, je unwahrscheinlicher die Fertilität der betroffenen Gonade ist und bei einseitigem Befund.
4. Die Implantation einer Hodenprothese. Aus kosmetischen und psychischen Gründen gibt es die Möglichkeit der Hodenprothesenimplantation (19). Die Prothese besteht heute aus einem Silikonelastomer und ist in 3 verschiedenen Größen lieferbar (31x23mm; 37x28mm; 42x32mm; Fa.: AMS / Deutschland). Für die Implantation inzidieren wir längs im Bereich der oberen Scrotalapertur durchtrennen die Tunica dartos und positionieren die Prothese an regulärer Stelle.
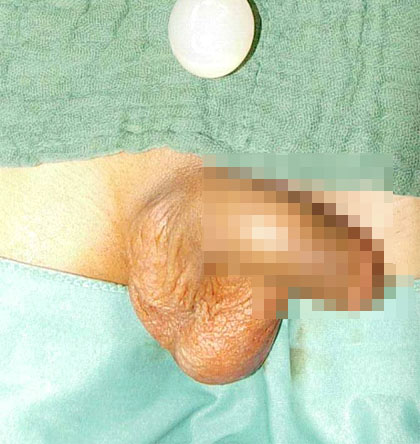
Abb. 12: Vorbereitung der Hodenprothese
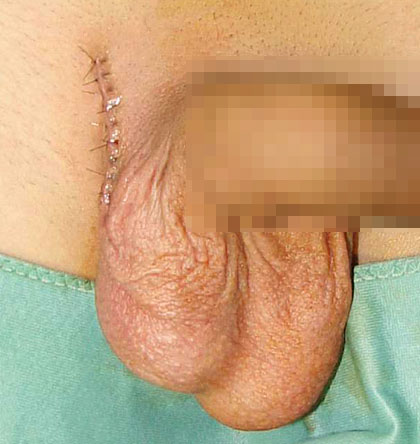
Abb. 13: Nach Hodenprothesenimplantation
Zusammenfassung:
Bei allen Formen der Hodenretention sowie Hodenektopie ist eine operative Korrektur angebracht, in Form der typischen Orchidolyse und der skrotalen Orchidopexie. In den letzten Jahren wurde der optimale Operationszeitpunkt um das 1. Lebensjahr festgelegt, da in diesem Operationsalter ein normaler Fertilitätsindex zu erwarten ist. Ob damit auch eine Senkung des Malignomrisikos zu erwarten ist kann zum heutigen Zeitpunkt noch nicht gesagt werden. Die prä- und gegebenenfalls auch postoperative Hormontherapie hat günstige Einflüsse auf die Fertilität und die Operationsbedingungen, auch wenn sie keinen Descensus herbeiführen konnte. Bei Orchidolysen und - pexien im frühen Säuglingsalter besteht allerdings ein höheres Risiko einer Samenstrangtraumatisierung und damit die Gefahr einer postoperativen Hodenatrophie. Letztere kann vermieden werden, wenn die Korrektur an einer spezialisierten Abteilung erfolgt.
Schlüsselwörter: Kryptorchismus, Maldescensus testis, Kinderchirurgie
Summary:
Surgical correction is indicated in all forms of undescended or ectopic testes. The surgical procedure in these cases is typical orchidolysis or scrotal orchidopexy. In the last few years, the age of about one year has been established as the optimal time for surgery, as a normal fertility index will be achieved. Whether the risk of malignancy is reduced by this early approach cannot be stated at the present time. Pre- and eventually postoperative hormone therapy has a beneficial effect on fertility and the conditions for surgery even if it has not lead to a descent of the testes. However, when orchidolysis or orchidopexy is performed in early infancy, the risk of trauma to the spermatic cord and postoperative testicular atrophy is greater. The latter can be avoided if the procedure is performed in a specialized department./p>
Key words: Undescended Testis, Pediatric Surgery
Literatur:
- Altman, B. L., Malament M. (1967) "Carcinoma of the testis following orchidopexy." J.Urol. 97: 498-504
- Atwell, J. D. (1985) "Ascent of the testis. Fact or fiction." Br.J.Urol. 75: 474-77.
- Bianchi, A. (1984) "Microvascular orchidopexy for high undescended testes." J.Urol. 56: 521-24.
- Clarnette, T. D. and J. Hutson. (1997) "Is the ascending testis actually stationary? Normal elongation of the spermatic cord is prevented by a fibrous remnant of the processus vaginalis." Pediatr Surg Int 12: 155-57.
- Elder, J. S. (1992) "Two-stage Fowler-Stephens orchiopexy in the management of intraadominal testes." J.Urol. 148: 1239.
- Fowler, B. and F. D. Stephens. "The role of testicular vascular anatomyin the salvage of high undescended testis." Aust.N.Z.J.Surg. 29 (1959): 92-100.
- Gehring, G. C., F. R. Rodriguez, and D. M. Woodhead. "Malignant degeneration of cryptorchid testes following orchidopexy." J.Urol. 112 (1974): 354-56.
- Gilbert, J. B. and J. B. Hamilton. (1940) "Incidence and nature of tumors in ectopic testes." Surg.Gynecol.Obstet. 71: 731-36.
- Hadziselimovic, F. (1987) "Hormonal treatment of the undescended testis." J.Pediatr.Endocrinol. 2: 1-5.
- Hutson, J. M. and S. W. Beasley. "The Postnatal Effect of Cryptorchidism." Ed. Hutson J.M. and Beasley S.W. 1 ed. Lonodon - Melbourne - Auckland: Edward Arnold, 1992. 74-90.
- Johansen, T. E. B. (1987) "Anatomy of the testis and epididymis in cryptorchidism." Andrologia 19: 565-69.
- Johnson, D. E. et al. (1968) "Cryptorchidism and testicular tumorigenesis." Surgery 63: 919-22.
- King, L. R. (1984) "Optimal treatment of children with undescended testes." J.Urol. 131: 734-35.
- Lala, R. et al. (1992) "Early medical and surgical treatment of crytorchidism:clinical, anatomic and histologic finding." Pediatr Surg Int 7: 368-71.
- Martin, D. C. and H. R. Menck. (1975) "The undescended testis: Management after puberty." J.Urol. 114: 77-85.
- Mayr, J. et al. (1993) "Course of Pubic Tubercle - Centre of Testicle Distance in Children with and without Testicular Maldescent." Eur.J.Pediatr.Surg. 3: 33-36.
- McAleer, I. M., M. G. Packer, and G. W. Kaplan. (1995) "Fertility index analysis in cryptorchidism." J.Urol. 153: 1255-58.
- Mengel, W. et al. (1974) "Studies on cryptorchidism: a comparison of histological findings in the germinative epithelium before and after the second year of life." J.Pediatr.Surg. 9: 445-50.
- Pauanik, S. R., L. F. Mencia, and M. G. Gilbert. (1973) "Artificial testicles in children: A new silastic gel testicular prosthesis." J.Urol. 109: 735-36.
- Schoemaker, J. (1932) "Über Kryptorchismus und seine Behandlung." Chirurg 1: 1-9.
- Scott, L. S. (1967) "Delayed treatment of cryptorchidism with subsequent infertility." Fertil.Steril. 18: 782-90.
- Silber, S. J. and J. Kelly. (1976) "Successful autotransplantation of an intraabdominal testis to the scrotum by microvascular technique." J.Urol. 115: 452-54.
- Whitaker, R. H. (1988) "Neoplasia in cryptorchid men." Semin.Urol. 6: 107-09.
- Wilson-Storey, D. and A. E. MacKinnon. (1992) "The laparoscope and the undescended testis." J.Pediatr.Surg. 27: 89-92.s
Weiterführende Informationen/Studien:
Der Hodenhochstand (Maldescensus testis), Kryptorchismus







